こんにちは、eURO2023です!
今回は、基礎研究の備忘録シリーズとして、Flow cytometry を用いた早期アポトーシス検出についてまとめます。
Flow cytometryって研究初学者からしたら、敷居が高いです。手順も多いし煩雑で、解析なんかも難しいし…。ということで、今まで「あえてやらなくて良いなら」と避けていましたが(苦笑)、とうとう始めることになってしまいました。
私自身は、いわゆるプロのテクニシャンではなく、医師として片手間に実験をしている立場です。そのため、厳密さに欠ける部分や、よりよい手順があるかもしれませんが、初学者の方が「とりあえず一通りやってみる」ための参考になればと思い、記事にしました。
Flow cytometry 自体はとても奥が深いのですが、ここでは Annexin V-FITC / PI を用いた、ごく基本的なアポトーシス検出実験に絞って、実務的な手順や注意点をまとめます。
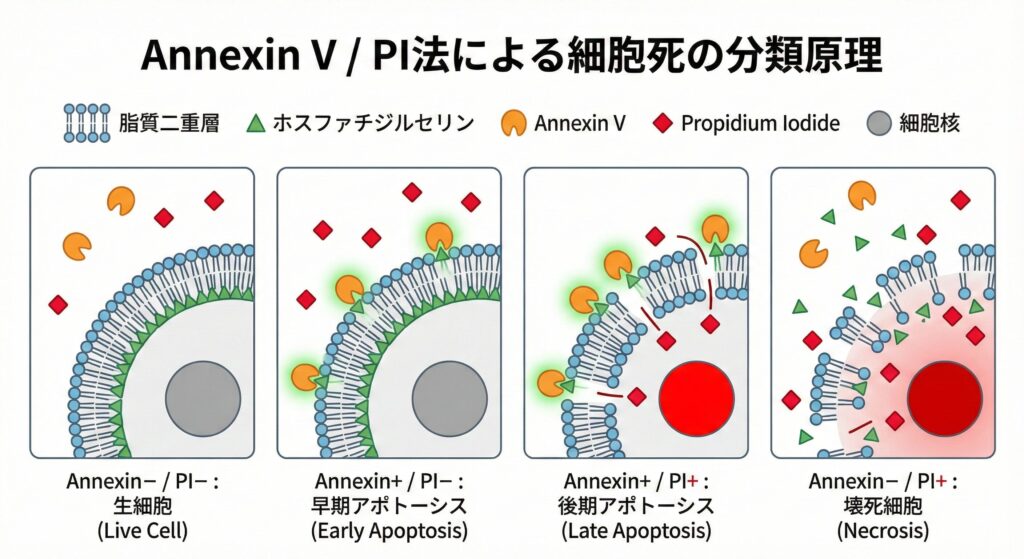
Annexin V-FITC / PIの原理
Annexin V と PI(Propidium Iodide)の原理については、メーカーや各種解説サイトで詳しく説明されています。ここでは、ざっくりとしたイメージだけ整理し、詳しいところは公式ページにお任せします。
Annexin Vを測定する意義
アポトーシスの早期には、細胞膜を構成する脂質二重層に変化が起こります。
そのひとつが、本来は脂質二重層の内側に存在するホスファチジルセリン(PS)が、外側に露出してくるという現象です。
Annexin V は、この PS に Ca2+存在下で強い親和性をもって結合します。
したがって、早期アポトーシスに陥った細胞では、蛍光色素(ここでは FITC)で標識された Annexin V が細胞表面に結合し、フローサイトメトリーで検出できるようになります。
PIを測定する意義
PI(Propidium Iodide)は、DNAに結合して赤色蛍光を発する色素です。
分子量が 668 Da と比較的大きく、強い正電荷(カチオン性)をもつため、正常な脂質二重層(細胞膜)を自力で通過することはできません。
しかし、アポトーシス後期やネクローシスなどで、細胞膜が破綻すると、PI が細胞内に流入し DNA と結合できるようになります。
このとき、細胞内の DNA に結合した PI が強い蛍光を発し、フローサイトメトリーで検出可能になります。
Annexin V (FITC) と PI を二次元プロット上で組み合わせて評価することで、
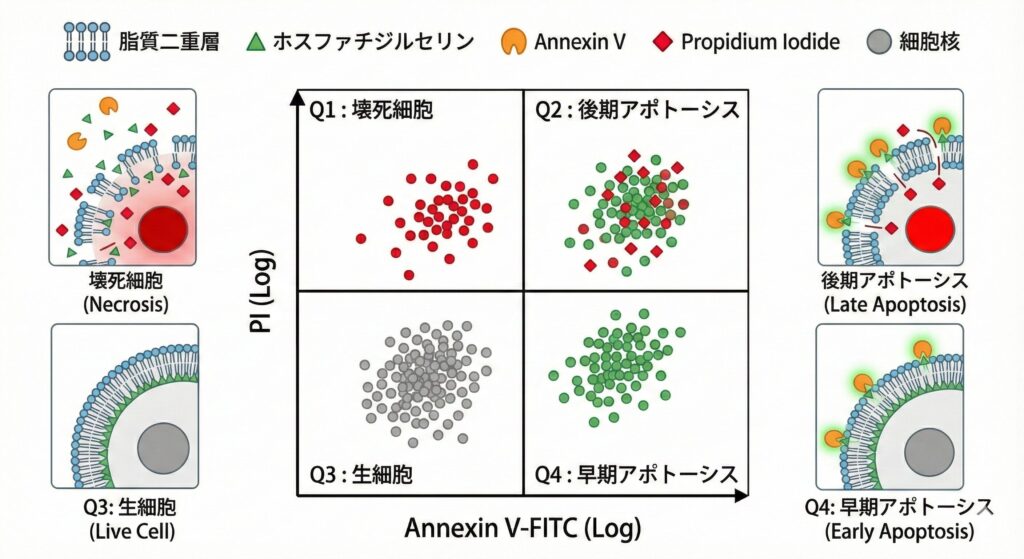
- Annexin− / PI−:生細胞
- Annexin+ / PI−:早期アポトーシス
- Annexin+ / PI+:後期アポトーシス
- Annexin− / PI+:壊死細胞
という4つの集団に大きく分類することができます。
下準備
今回の実験では、MEBCYTO Apoptosis Kit(Annexin V-FITC Kit)を使用しました。
主な必要物品を以下にまとめます。
以下は一例として挙げているものであり、特定の製品を推奨する意図はありません。
| Flow Tubes チューブ 未滅菌 4000個入 T9020 MTC Bio 価格:56,160円(税込、送料別) (2025/11/22時点) 楽天で購入 |
実験の流れ
- 72時間前目的の細胞を播種(10cmプレートなど)
細胞株や目的に応じて、播種密度や培地の条件は適宜調整してください。
- 24時間前目的の薬剤を投与(24時間後のアポトーシス検出のため)
24時間暴露後の効果を見たい場合の一例です。実際には薬剤の強さや細胞の感受性に応じて、投与タイミングを調整します。
- 6時間前目的の薬剤を投与(6時間後のアポトーシス検出のため)
12時間・18時間など、複数の暴露時間を設定しておくと、時間依存的な変化も追いやすくなります。
- 2時間30分前細胞の準備
- 細胞を Trypsin-EDTA または Accutase で処理して剥がす。
- 培地を加えて計 10 mL とし、Trypsin を中和する。
- 細胞数を測定し、1×106 cells/mL となるように PBS(4℃)で懸濁する。
- この細胞懸濁液 500 µL を 5 mL フローサイトメトリーチューブに移し、遠心(1000 rpm, 3 分)。
- 上清を吸引除去する。
- Binding Buffer(ready-for-use)を 85 µL 加えて懸濁する。
- Annexin V-FITC 10 µL と PI 5 µL を加え、ピペッティングでよく混和する。
- 暗所・室温で 15 分間静置する。
- Binding Buffer 400 µL を加えて混和する(合計 500 µL、5×105 cells/tube)。
- 開始フローサイトメトリー開始
FSC/SSC、ゲーティング、compensation などの設定を確認しながら測定を行います(後述の「フローサイトメトリーのコツ」参照)。
- 接着細胞では、Trypsin-EDTA よりも Accutase の方が細胞へのダメージが少なく、アポトーシス解析との相性がよいとされることが多いです。
- 培地を加える理由は、Trypsin を中和することと、細胞を一度やさしくリフレッシュしてから PBS に置き換えるためです。
複数サンプルを同時に処理する場合は、あらかじめ Mastermix を作っておくと、全体に満遍なく抗体が行き渡り、手技もかなり楽になります。
例えば 10 本分を一度に準備する場合、Binding Buffer 850 µL、Annexin V-FITC 100 µL、PI 50 µL をあらかじめ混和しておき、各チューブに 100 µL ずつ分注します。
Non-staining(無染色)は 1 本あたり Binding Buffer 100 µL、FITC 単染色は Binding Buffer 90 µL+Annexin V-FITC 10 µL、PI 単染色は Binding Buffer 95 µL+PI 5 µL という形で準備しておくと、compensation の設定がスムーズです。
ちなみに、FITC単染色、PI単染色コントロールの作り方は以下の通りです。ここでは確実にFITC陽性、PI陽性を出したいので、強い方法で行います。
FITC陽性:細胞に Staurosporine(0.5〜1 µM程度) を加え、4〜6時間 インキュベートします(細胞種により調整。完全に死滅する手前の段階がベスト)。
PI陽性:50〜65℃ のウォーターバスやヒートブロックで 10〜15分間 加熱します(これで細胞膜がボロボロになります)。その後、氷上に戻して冷やします。
どちらも、「無処理の元気な細胞」を半分ほど混ぜるとよいかもしれません(陰性と陽性の2つの山を作るため)。
フローサイトメトリーのコツ
今回は BD の Symphony A5 SE を使用してフローサイトメトリーを行いました。装置ごとに細かい設定は異なりますが、基本的な考え方は共通です。
FSC / SSC の電圧は、まず 未処理のコントロール細胞を流し、メインの細胞集団がプロットの中央付近に来るように調整します。多くの細胞株では、FSC が 50〜100 付近に落ち着くことが多いですが、細胞サイズによってかなり変わるので、「絶対的な値」にこだわる必要はありません。
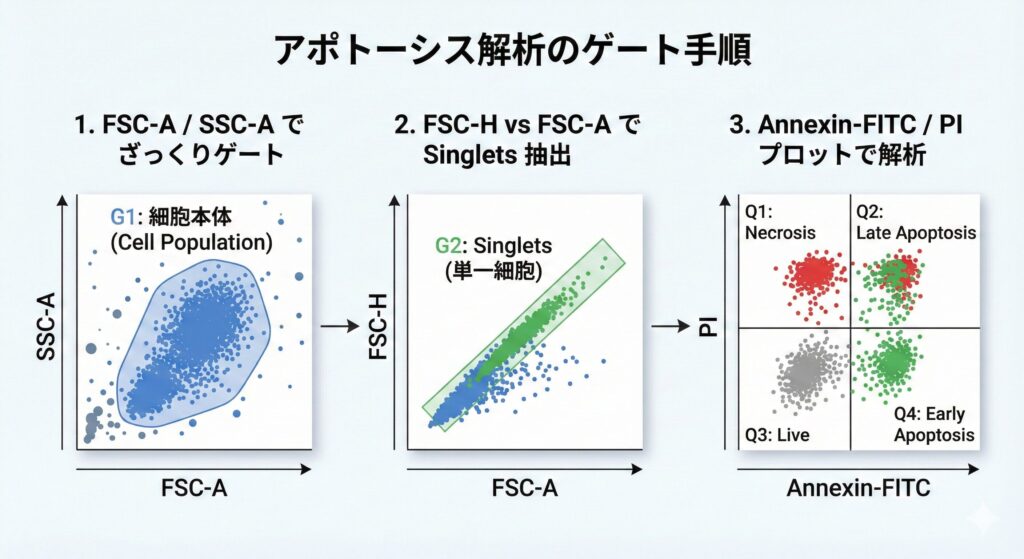
FSC/SSC プロットの左下に小さな点がバラバラと出る場合、それはほとんどが デブリ(細胞片)や死細胞です。アポトーシス解析では、
- FSC-A / SSC-A で、細胞本体のクラスタをざっくりゲート
- FSC-H vs FSC-A などで Singlets(単一細胞) を抽出
- そのうえで Annexin-FITC / PI の二次元プロットに進む
という順番でゲートを切ると、解析が安定します。
Compensation(蛍光補正)では、必ず
- Unstain(無染色)
- FITC 単染色(Annexin V のみ)
- PI 単染色
を用意し、各チャネルの spillover を補正します。装置やフィルター構成によって数値は変わりますが、個人的な感覚としては Comp 値が 20 以下に収まると扱いやすい印象です(もちろん、値そのものよりもプロットの見え方が重要です)。
最終的なゲートの見え方と、それぞれの意味合いは下記の図の通りです。
Symphony A5 SEなどはFACS DIVAソフトウェアを用いて上記の作業を行います。
下記のYoutubeビデオが非常に丁寧でわかりやすいので、参考にしてください!
(残念ながら、日本語での解説動画は見当たりませんでした。知っている方がいらっしゃったら是非教えてください!)
トラブルシューティング
実験がうまくいかない時は、以下のポイントをチェックしてみてください。フローサイトメトリーは「生きた細胞」を相手にするため、核酸抽出などに比べて非常にデリケートです。
Annexin V 陽性がほとんど出ない
- 薬剤の条件検討不足:濃度が低すぎる、または曝露時間が短すぎて、まだアポトーシスが起きていない可能性があります。
- Ca²⁺不足による結合不全:Annexin VがPSに結合するにはカルシウムイオン(Ca²⁺)が必須です。最後の懸濁にPBS(-)を使うと、Ca²⁺が含まれていないのでAnnexin Vが検出されなくなります。必ずキット付属のBinding Bufferを使用してください!
- 洗浄によるロス:アポトーシスを起こした細胞は接着が弱くなり、培地中に浮遊しています。PBS洗浄の際に、浮いている重要な細胞を吸引して捨ててしまっている可能性があります。最初の培地は破棄せずに採取して、遠心かけておくといいかもしれません。ただ、印象としては浮遊細胞はごくわずかなので、あまり大勢に影響しない気もしています。
FITC シグナルが全体的に弱い
- 光退色(Photobleaching):蛍光色素は光に弱いです。インキュベーション中や移動中はアルミホイルで覆うなど、徹底的に遮光してください。
- 温度条件:氷上ではなく室温で反応させるキットの場合、温度が低すぎると結合効率が落ちることがあります(プロトコルを確認してください)。今回紹介したキットでは、室温15分推奨です。
PI シグナルが全体的に高い / コントロール群でも死細胞が多い
- 細胞の培養状態:実験開始時にすでに細胞が弱っていませんか?(過密、培地が古い、継代数が多すぎるなど)。
- トリプシン処理の過剰:トリプシンなどの酵素処理が長すぎると、細胞膜がダメージを受けて「偽陽性(本来生きているのに染まってしまう)」の原因になります。
- 物理的ダメージ:ピペッティングが激しすぎる、または遠心条件が強すぎると、物理的に膜が破れます。
- 測定までの待ち時間:染色後、測定までに時間が空きすぎると、氷上であっても細胞は徐々に死んでいきます。染色後は1時間以内に測定するのが良いそうです。
細胞を壊すRNA・DNA・タンパク抽出などと違い、細胞にダメージを与えないように細胞を処理するのはとても難しい印象です。
非薬剤投与群でも死細胞が多く出てしまう時には激萎えです。
細胞を傷めないコツ
1. トリプシンではなく「Accutase」を使う:記事内でも触れましたが、アポトーシス解析においてトリプシンは諸刃の剣です。細胞剥離剤を「Accutase」などのマイルドな酵素に変えるだけで、バックグラウンドの死細胞率が劇的に下がることがあります。
2. 遠心ブレーキを「Soft / Low」にする:通常の遠心機設定(急停止)だと、沈殿した細胞ペレットが舞い上がったり、圧力がかかったりします。遠心機のブレーキ設定を「Low」または「Off(自然減速)」にすると、細胞への物理的ストレスが減ります。
3. ピペッティングは「優しく、回数を減らす」:細胞を懸濁する際、ダダダッと激しくピペッティングしていませんか?
- チップの先端は、口径が広いもの(ワイドボアチップ)を使う。
- 泡立てないように、ゆっくりとピペッティング。
- 完全に単一細胞(Single cell)にしなくても、FSC/SSCでゲートを切ればある程度は解析可能です。「完全にバラバラにしなきゃ」と執拗にピペッティングするより、少し塊があっても生きたまま測定する方が重要かもしれません。
4. 常に「氷上」をキープ:室温処理(37℃)以外の工程は、すべて氷上(4℃)で行います。低温にすることで細胞の代謝を落とし、実験操作による「意図しないアポトーシスの進行」や「ネクローシス」を最小限に食い止めます。
5. タッピングを活用する:ペレットをほぐす際、いきなりピペッティングや激しいボルテックスをするのではなく、チューブの底を指でトントンと弾く(タッピング)、あるいはチューブをラックで優しくスライドさせる方法でほぐしてから、バッファーを加えるとダメージが少ないと言われています。
まとめ
Annexin V-FITC / PI を用いたアポトーシス解析は、もっとも基本的で、かつ応用範囲の広いフローサイトメトリー実験のひとつです。
ポイントを改めてまとめると、
- 非染色・単染色・フル染色を揃えて測定し、Compensation をきちんとかける
- FSC/SSC → Singlets → Annexin/PI の順にゲートを切り、デブリやダブルレットを除外する
- 細胞をできるだけやさしく扱い、手技由来の膜ダメージを最小限にする
Flow cytometry は、ちょっとした条件の違いで結果が大きく変わるテクニックだと実感しています。もし、「自分はこうしている」「ここは違うやり方が良い」などの知見があれば、ぜひ教えていただけると嬉しいです。
この記事も、今後の実験のなかで少しずつアップデートしていく予定です。
参考にしたブログ・HP・文献
- FACS DIVAチュートリアル(https://www.youtube.com/watch?v=yRlO15_da3M&t=1103s):英語ですが、日本語訳だせます
- MBLホームページ(https://ruo.mbl.co.jp/bio/product/apoptosis/annexin.html):Annexin V / PI kitについての内容が記載されています。



コメント