こんにちは、eURO2023です!
基礎研究の備忘録シリーズです。
Real-time RT-PCRのためにtotal RNAが必要ですが、臨床検体から得られたRNAは濃度が非常に低いことがあります。
このような場合、cDNAの作成に向けて、RNAの濃縮が必要な場合があります。
私はエタノール沈殿を行いました。
最近はキットを用いた濃縮も可能なようですが、メリット・デメリットを比較して、結局古典的な手法に落ち着きました。
そこで今回は、エタノール濃縮について調べてみました!
各手法の「原理」を知っているかどうかで、実験の成功率(と、その後のNGS解析やPCRの質)は大きく変わると考えています。
1970年代からある古典的な手法から、2025年現在の最新マイクロ流体技術まで、RNAを「濃縮」し「きれいにする」技術を、最新のリサーチ結果をもとにわかりやすく解説します。
1. 敵を知る:なぜRNAは扱いにくいのか?
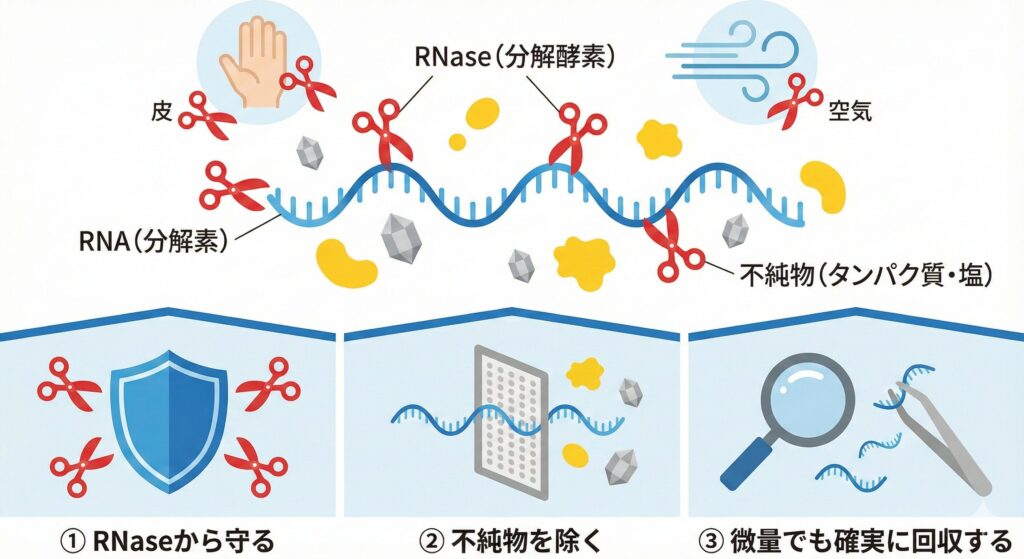
RNAは一本鎖構造であり、非常に不安定です。そして私たちの周り(皮膚、空気中、実験台)には、RNAを分解する酵素「RNase(リボヌクレアーゼ)」がうようよしています [1]。
RNA濃縮の目的は単に体積を減らすことだけではありません。
- RNaseから守る
- 不純物(タンパク質や塩)を除く
- 微量でも確実に回収する
この3つを同時に達成する必要があります。
2. 古典的にして最強?「アルコール沈殿法」をマスターする
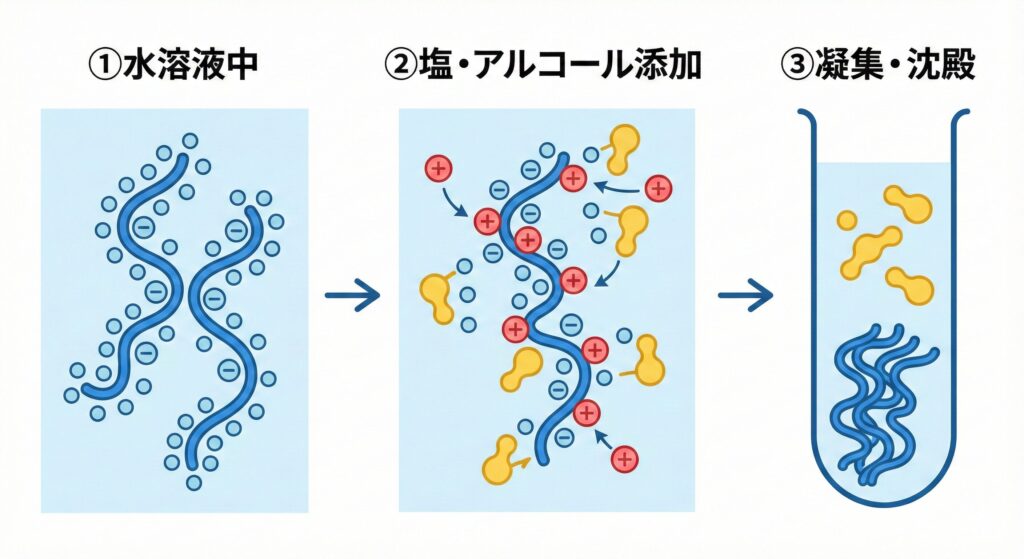
アルコール沈殿とは何でしょう?
水に溶けているRNAに、塩(陽イオン)とアルコールを加えることで、RNAの周りの水分子(水和層)を剥がし、電気的に中和して凝集(沈殿)させます [2, 3]。
ここでは、よく使われるエタノールとイソプロパノールの使い分けを整理してみます。
エタノール vs イソプロパノール
| 特性・条件 | エタノール沈殿 | イソプロパノール沈殿 |
| 添加量 | サンプルの 2.5 ~ 3.0 倍 [1, 3] | サンプルの 0.6 ~ 1.0 倍 [2, 3] |
| 得意なこと | 小さなRNA (<200 bp) も回収できる [2, 4] | 大量の液量を扱える(添加量が少なくて済むため) |
| 塩の共沈 | リスクが低い(塩は溶けたまま) | リスクが高い(塩も一緒に沈殿しやすい) [2, 5] |
| 乾燥 | 揮発性が高く、すぐ乾く | 乾燥しにくい |
| 推奨用途 | 通常の精製、微量サンプル | 大容量サンプルの最初の濃縮 |
ポイント:下流で酵素反応(PCRなど)をするなら、塩の持ち込みが少ないエタノールが無難です。逆に、「液量が多すぎてチューブに入らない!」という時はイソプロパノールの出番です。
「見えない沈殿」を見えるようにする:共沈剤(キャリアー)
微量なRNA(10 µg/mL未満)は、アルコールを入れても沈殿しません。そこで「核」となる物質(キャリアー)を入れます。
- グリコーゲン: カキ(牡蠣)由来。白くはっきり見えるので初心者に最適。ただし、吸光度測定(A230)に少し影響すると言われています [4, 6]。
- tRNA / Total RNA: 沈殿効率は良いですが、「他生物のRNA」を混ぜることになるため、RNA-seqを行う場合は厳禁です [7, 8]。
- リニアアクリルアミド / Ethachinmate: 化学合成品。NGS解析にも悪さをせず、冷却なしで即座に遠心できる製品(日本遺伝など)もあり、現代のスタンダードになりつつあります [9, 10]。
エタノール沈殿法
あくまで一つの方法ですが、私がラボで行っているエタ沈の流れについて提示しておきます。
- Total RNA 25μL, Glycogen 2μL, 3M NaOAc 12μL, 100% ethanol 81μL (total 120μL) これらを混合し、ピペッティング
- Dryice 20分以上(もしくは-80度)
- 4℃, 15000 rcf, 20分で遠心
- ピペットで上清を優しく除去
- 500μLの冷70% ethanolを加える
- 4℃, 15000 rcf, 5分で遠心
- ピペットで上清を優しく除去
- チューブの蓋を開けたままで10分程度静置し、乾かす(乾かしすぎに注意!)
- RNAペレットを、IDTE buffer (IDT)などで溶かす(私は10μLを用いていました)
- Nanophotometerで吸光度測定
3. 現在のスタンダード:シリカカラムと磁気ビーズ
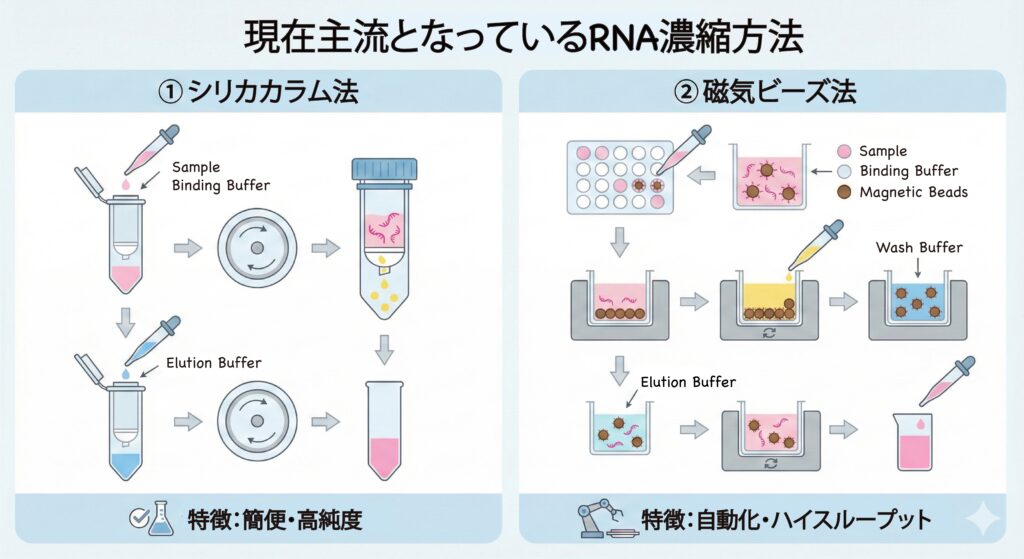
最近は「マニュアルでエタ沈」に替わる様々な手法が登場してきました。
シリカメンブレン(スピンカラム)
「カオトロピック塩」という特殊な塩溶液中で、RNAをシリカ(ガラス繊維)の膜に結合させます。
- メリット: 遠心するだけで不純物をしっかり洗える。
- 注意点: 膜に吸着させる際に、長いRNAが物理的に切れることがある。
磁気ビーズ(Magnetic Beads)
2025年現在、臨床検体や自動化装置(KingFisherなど)で主流なのがこれです。磁石にくっつくビーズの表面にRNAを吸着させます。
- メリット: 遠心分離が不要。自動化しやすい。
- 注意点: ビーズを乾燥させすぎると、RNAが離れなくなります(過乾燥に注意!) [11]。
4. 研究の最前線(2025年のトレンド)
ここからは少しマニアックですが、最新技術についても触れておきます。下記方法については、必ずしもRNA濃縮のためのみに使われる訳ではありません。
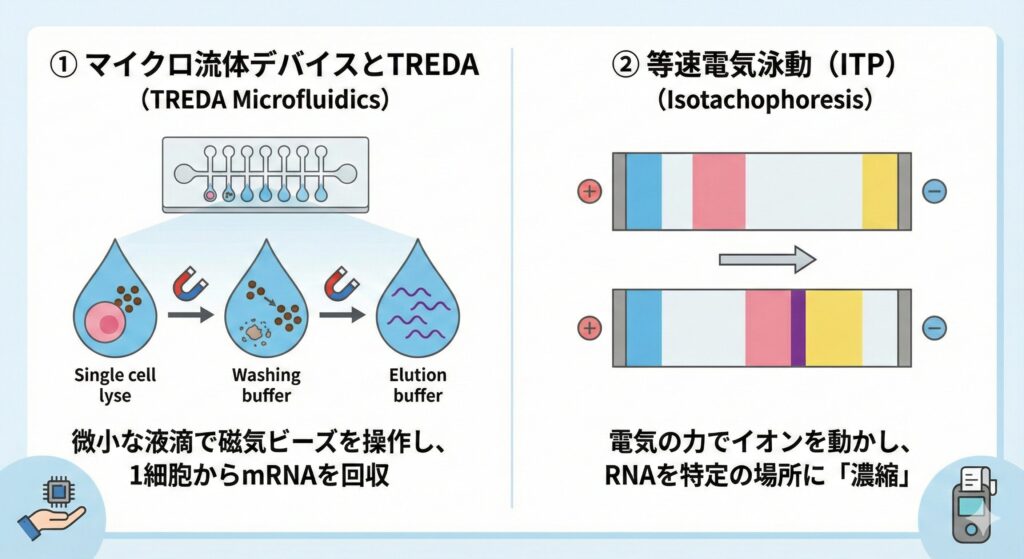
マイクロ流体デバイスとTREDA
「1個の細胞」からRNAをとりたい。そんなニーズに応えるのがマイクロ流体技術です。
TREDA (Total RNA Extraction Droplet Array) は、微小な液滴(ドロップレット)の中で磁気ビーズを動かし、ごく微量の細胞からmRNAを回収します [12]。
等速電気泳動(ITP)
電気の力でイオンを動かし、特定の場所にRNAを「濃縮(シャープニング)」する技術です。
紙(ペーパーデバイス)の上で行うキットも開発されており、電源のない場所での感染症診断などに応用されています [13]。
5. 失敗しないための品質管理(QC)

せっかく濃縮したRNA、質が悪ければデータは使えません。
- 純度 (A260/A280比): 1.9 ~ 2.1 ならOK。
- A260/A230比: これが低い(1.8以下)と、フェノールや塩が残っている場合があります。PCRがかかりにくくなる可能性があります [14, 15]。
- RIN (RNA Integrity Number): RNAが分解していないかのスコア(1〜10)。NGS解析ならRIN 7以上を目指すのが望ましいと言われています [16]。
miRNAを扱う場合の注意
血液中などのマイクロRNA (miRNA) を扱う場合、キット選びが命です。
Qiagen (miRNeasy) や Macherey-Nagel (NucleoSpin) が、血漿サンプルからの回収率で安定して高評価を得ています [17, 18]。
まとめ:医師・研究者としての使い分け
RNA濃縮技術は、目的によって使い分けるのが正解です。
- コスト重視・基礎実験・DNA除去: アルコール沈殿(エタノール + 酢酸Na)
- 大量サンプル・時短: イソプロパノール沈殿
- ルーチンワーク・品質重視: シリカカラムキット
- 多検体処理・自動化: 磁気ビーズ
- 超微量・シングルセル: マイクロ流体・チップ技術
実験手法は日進月歩ですが、原理を知ることでトラブルシューティングも上手くできると思います。
通常の研究室ではアルコール沈殿やカラムによる濃縮が行われることと思いますが、他の最先端技術もそのうち日常の実験に使えるようになるかもしれませんね。
参考にした文献・HP
- Working with RNA | Thermo Fisher Scientific- US (https://www.thermofisher.com/us/en/home/life-science/dna-rna-purification-analysis/rna-extraction/working-with-rna.html)
- DNA-Precipitation-EtOH-or-Isopropanol (https://www.science.smith.edu/cmbs/wp-content/uploads/sites/36/2019/02/DNA-Precipitation-EtOH-or-Isopropanol.pdf)
- DNA & RNA Precipitation Solutions – Gene Link (http://www.genelink.com/Literature/ps/PS40-5132_PptionSoln_Ver3.3.pdf)
- Glycogen, RNA grade – Fisher Scientific (https://assets.fishersci.com/TFS-Assets/LSG/manuals/MAN0013149_Glycogen_RNA_grade_UG.pdf)
- Ethanol v/s Isopropanol for DNA precipitation – ResearchGate (https://www.researchgate.net/post/Ethanol-v-s-Isopropanol-for-DNA-precipitation)
- How could the yield of RNA be increased a bit by adding “glycogen” while extraction of RNA from animal cells? | ResearchGate (https://www.researchgate.net/post/How_could_the_yield_of_RNA_be_increased_a_bit_by_adding_glycogen_while_extraction_of_RNA_from_animal_cells)
- How do you use linear acrylamide as a co-precipitant during RNA isolation? | ResearchGate (https://www.researchgate.net/post/How_do_you_use_linear_acrylamide_as_a_co-precipitant_during_RNA_isolation)
- Coprecipitants for Demanding Molecular Biology Applications – Thermo Fisher Scientific (https://www.thermofisher.com/us/en/home/references/ambion-tech-support/rna-buffers-chemicals/tech-notes/coprecipitants-for-demanding-molecular-biology-applications.html)
- エタ沈メイト – ニッポン・ジーン (https://www.nippongene.com/siyaku/product/extraction/pdf/leaf_ethachinmate.pdf)
- Ethachinmate – ニッポン・ジーン (https://www.nippongene.com/english/product/extraction/ethachinmate.html)
- Automating Nucleic Acid Extraction – Promega Corporation (https://www.promega.com/resources/technologies/lab-automation-resource-center/automating-nucleic-acid-extraction/)
- Xu Shi et al. Parallel RNA extraction using magnetic beads and a droplet array. Lab Chip. 2014 Dec 18;15(4):1059–1065.
- Moghadam BY et al. Isotachophoretic preconcenetration on paper-based microfluidic devices. Anal Chem. 2014 Jun 17;86(12):5829-37.
- RNA isolation and reverse transcription – Abcam (https://www.abcam.com/en-us/technical-resources/protocols/rna-isolation-and-reverse-transcription)
- Dang T et al. A comparative analysis of RNA isolation methods optimized for high-throughput detection of viral pathogens in California’s regulatory and disease management program for citrus propagative materials – Frontiers (https://www.frontiersin.org/journals/agronomy/articles/10.3389/fagro.2022.911627/full)
- RNA Integrity Number (RIN) – Standardization of RNA Quality Control Application | Agilent (https://www.agilent.com/cs/library/applications/5989-1165EN.pdf)
- Assessment of six commercial plasma small RNA isolation kits using …, https://academic.oup.com/biomethods/article/1/1/bpw003/2629267
- Assessment of six commercial plasma small RNA isolation kits using qRT-PCR and electrophoretic separation: higher recovery of microRNA following ultracentrifugation – ResearchGate, https://www.researchgate.net/publication/311876620_Assessment_of_six_commercial_plasma_small_RNA_isolation_kits_using_qRT-PCR_and_electrophoretic_separation_higher_recovery_of_microRNA_following_ultracentrifugation
・えいこラボ「DNA抽出時のエタノール沈殿法とイソプロパノール沈殿法の違い」(https://eiko-lab.com/2021/06/10/ethanol_isopropanol):古典的な手法についてわかりやすく説明されています!



コメント